卫材将在2022年阿尔茨海默病协会国际会议(AAIC)上展示包括ARIA-E和皮下给药方面的lecanemab最新数据以及其它阿尔茨海默病研究
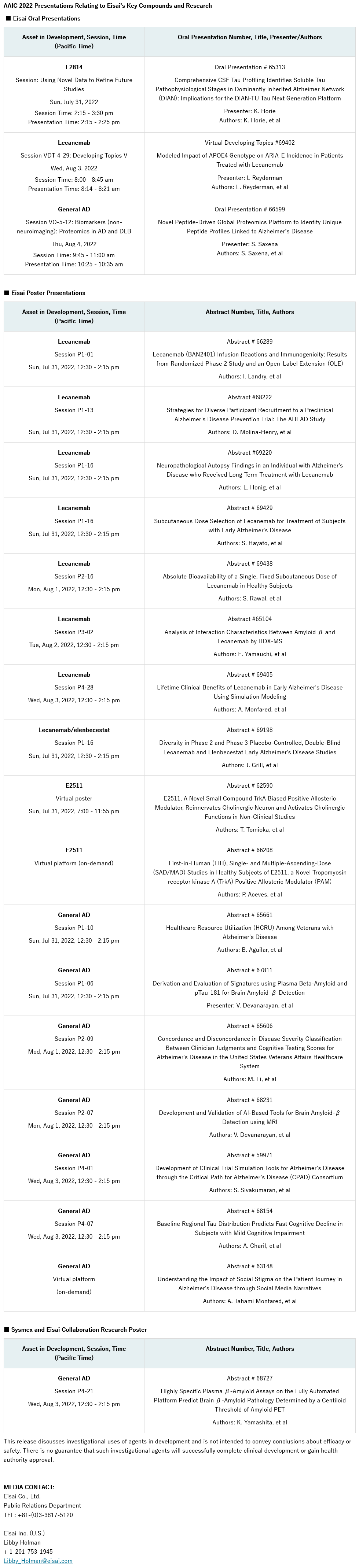
卫材株式会社(以下简称“卫材”)7月26日宣布,公司将于2022年7月31日到8月4日在美国圣地亚哥举行的阿尔茨海默病国际会议(AAIC)上展示其阿尔茨海默病(AD)研究项目的新数据,包括lecanemab (BAN2401)的最新数据。lecanemab是一种研究性药物抗β淀粉样蛋白(Aβ)原纤维抗体,用于治疗阿尔茨海默病(AD)引起的轻度认知障碍(MCI)和轻度AD(合称为早期AD)。卫材将在会议上以三次演讲和18个海报展示形式发布数据和研究结果。
2022年7月5日,美国食品药品监督管理局(FDA)接受了卫材lecanemab的生物制品许可证申请(BLA),并给予优先审查,处方药申报者付费法案(PDUFA)的目标评审日期为2023年1月6日。Clarity AD的主要终点数据将于2022年秋季公布。FDA已经同意Clarity AD的结果完成后,可以作为验证lecanemab临床疗效的验证性研究。
卫材AAIC重点演讲
1. 基因型对Lecanemab致ARIA-E发病的影响:
201 Core研究评估了APOE4基因型对ARIA-E发病率影响的建模和模拟结果,并且与新接受lecanemab治疗的开放标签扩展患者中观察到的发病率进行了比较。
2. Lecanemab皮下给药:
在健康受试者中评估lecanemab的绝对生物利用度、药代动力学、安全性和免疫原性的研究结果,单次皮下固定剂量为700mg。
建模和模拟分析旨在显示lecanemab每周固定周皮下剂量与基于体重的10mg/kg双周静脉注射剂量的等效性。
3. 卫材临床试验中的族裔和种族多样性:
对lecanemab (Study 201和Clarity AD)和elenbecestat MissionAD早期研究在美国的注册情况进行评估,评估种族和族裔群体以及资格标准的影响。
4. β-淀粉样蛋白实验预测脑β-淀粉样蛋白病理:
卫材和Sysmex合作的数据报告了全自动血浆Aβ40和Aβ42免疫测定,以及它们预测淀粉样PET定义的脑Aβ病理的性能。
5. 显性遗传阿尔茨海默病网络(DIAN)的综合CSF Tau分析:
演讲将分享一项研究的结果,该研究在华盛顿大学医学院的DIAN观察队列中登记的患者中,使用卫材的抗微管结合区(MTBR)抗体E2814来分析MTBR-tau,然后评估CSF中MTBR-tau变化的时间与临床、认知和生物标志物变化的相关性。
卫材美国阿尔茨海默病与脑健康高级副总裁、副首席临床官Michael Irizarry博士表示,“即将在2022年AAIC上展示的lecanemab数据会继续建立研究性抗淀粉样β原纤维抗体的知识体系,卫材也将在今年秋季进行第三阶段验证性Clarity AD读数。提交的其它研究将强调了卫材在美国早期阿尔茨海默病临床试验中为改善族裔和种族多样性所做的努力,因此研究人群反映了美国医疗保险人口情况,以及我们与Sysmex合作进行的可能有助于阿尔茨海默病早期诊断的潜在生物标记物的研究。”
本公告讨论了药物开发中的研究用途,不打算传达关于疗效或安全性的结论。不能保证这类试验性制剂将成功完成临床开发或获得卫生当局批准。